Finalmente, arrumei tempo para postar a nossa aula de proteínas aqui. Lembram-se de algo? Bem, vou refrescar a memória de vocês.
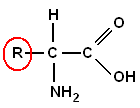
Logo no início da aula, fiz questão em mostrar para todos que as proteínas são macromoléculas formadas por estruturas chamadas de aminoácidos. E aminoácidos, como dito em aula, são moléculas construídas por um radical AMINO (-NH2), outro radical ÁCIDO, no caso, um ácido carboxílico (-COOH) e um radical específico (R). Há cerca de 20 aminoácidos existentes e estes são classificados em:
- Naturais: Quando produzidos, naturalmente, pelo corpo.
- Essenciais: Quando nosso corpo não possui a capacidade de produzí-los e, portanto, precisamos obtê-los diretamente da alimentação.
Abaixo, temos um esquema que mostra a estrutura de um aminoácido
Estrutura primária:
É importante lembrar que cada proteína, seja ela classificada como primária, secundária, terciária ou quaternária, só será funcional se estiver sempre dentro da sua classificação quanto a forma. Portanto, a hemoglobina só será efetiva em transportar o oxigênio se, e somente se, estiver em sua estrutura quaternária. Após isso, vimos que as proteínas são utilizadas para uma série de funções em nosso organismos: transporte, defesa, estrutural, contração e movimentação celular, coagulação sangüínea e função de catálise.
Quando chegamos neste ponto, demos ênfase ao que chamamos de proteína de catálise, isto é, uma proteína que acelera as reações químicas do nosso corpo. Esse tipo de proteína chama-se ENZIMA.
As enzimas possuem propriedades bastante específicas e só funcionam em ambiente próprio. Vimos que uma enzima que degrada sacarose, por exemplo, só poderá degradar sacarose devido a sua especificidade. Nunca poderá degradar proteínas, lipídios ou qualquer tipo de molécula. A essa propriedade chamamos de
"Chave-Fechadura", e tudo aquilo sobre o qual a enzima irá reagir é chamado de SUBSTRATO. A região da enzima onde o substrato se liga é conhecida como CENTRO ou SÍTIO ATIVO. Então, no caso do nosso exemplo com a enzima que reage sobre a sacarose, o substrato é, sem dúvida, a própria sacarose.
Em termos de "ambiente de trabalho", as enzimas são também específicas e obedecem a uma temperatura e pH (medida de acidez do meio). Isso mostra que enzimas trabalham melhor em certas temperaturas e também em certos níveis de acidez. Passando desses níveis, a enzima (lembre-se que toda enzima é uma proteína, porém, nem toda proteína é uma enzima) tende a se desnaturar (atentem para esse termo) e perder sua conformação, fazendo como que sua função também se perca, tornando-se ineficiente.


Nenhum comentário:
Postar um comentário